胎盘发育的时间线:胎盘发育的第一步是囊胚壁的形成(大约胚胎期E3.0-3.5天)。植入后(~E4.5),胚胎外内胚层逐渐排列在囊胚壁的内表面(~E4.5-5.0),形成卵黄囊,为胚胎提供组织营养支持;随后,脐带(~E8.5)的形成支持向绒毛尿囊胎盘的过渡和血行营养。完全成熟(“确定性”)胎盘由~E12.5建立。胎盘的组织起源是包括囊胚壁的滋养层,囊胚壁首先在大约E3.0-E3.5处形成。选择E5.5作为组织病理评估起点,因为此时小鼠胚胎通常已经进行了植入,并且作为胎盘原基的卵圆柱壁在这个阶段附近已经形成。选择E18.5作为胎盘评估终点,因为小鼠的出生通常发生在E19.0-E19.5,胎盘形态完全成熟。从E5.5开始,小鼠植入部位开始显示外胎盘锥的伸长和绒毛膜白云母胎盘的初始形成。绒毛膜卵黄蛋白胎盘由融合到卵黄囊的绒毛膜组成,卵黄囊促进血液交换相互作用,支持胚胎直到大约E8.5。
E0–E4.0:有效胎盘形成所需的胚胎发生早期事件,囊胚腔(即中央腔)的形成导致两个不同的细胞谱系的形成,即内细胞团(ICM)和滋养外胚层,它们定义了胚胎体轴的初始极性。
E4.5–E5.0:植入和初始胎盘形成,ICM已经发育成不同的细胞层,分为滋养外胚层(外层)、外胚层(中层)和原始内胚层(内层)。一旦与子宫内膜接触,壁滋养外胚层的滋养层巨细胞将进一步分化为负责调节蜕膜化的原代巨细胞,蜕膜化是母体子宫内膜逐渐重塑为支持受孕所需的特殊组织(称为蜕膜)的过程。随着ICM的继续分化,ICM的原始内胚层迁移到壁滋养层的内表面。
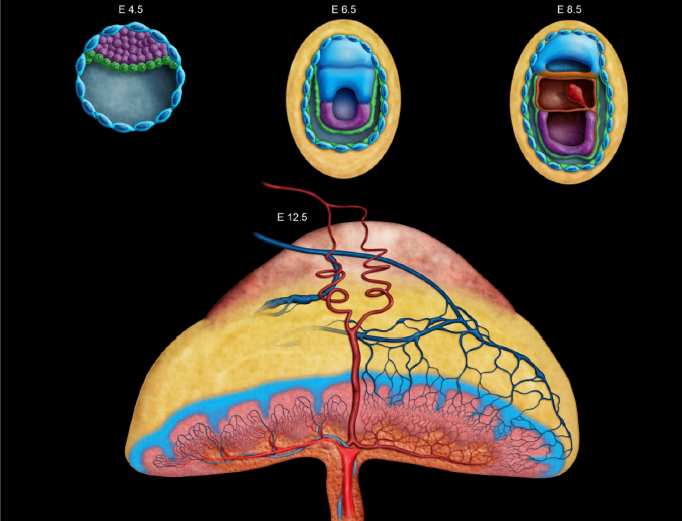
图1:小鼠胎盘形成关键发育时间点的图示,从胚胎第4.5天(E)植入到E12.5发育后期。胎盘发育始于E4.5,形成包围囊胚腔的外囊胚壁。从E5.0到E8.5的初始绒毛膜卵黄囊胎盘,通过胚胎细胞吞噬母体细胞和分泌物来支持组织营养。在E8.5,脐带形成,将胚胎连接到绒毛尿囊(迷路)胎盘,并允许结构转变,通过母体将营养和氧气转移到胚胎血液中,血行营养可能发生。胎盘层的生长持续到E12.5,此时“最终”(完全成熟)胎盘功能齐全,达到胎盘重量峰值。除了从迷路穿过交界区和蜕膜的蓝色静脉外,两条母体螺旋动脉显示为从绒毛膜板穿过子宫腺的红色螺旋血管。这里的颜色编码表示不同的组织在整个发育过程中形成和变化。在E4.5至E8.5中,胚胎本身呈深紫色。绿色表示原始内胚层,它将继续成为卵黄囊并包裹胚胎,而黄色表示母体蜕膜。蓝色有核细胞是滋养层巨细胞,排列在囊胚上,在整个早期胎盘形成过程中帮助蜕膜化。在E12.5胎盘中,位于黄色蜕膜组织顶部的淡橙红色帽是子宫腺。交界区被描绘为位于高度血管化的红粉色迷宫层上方的蓝色分支部分。绒毛膜板是容纳脐血管及其附着部位的橙色基底层。
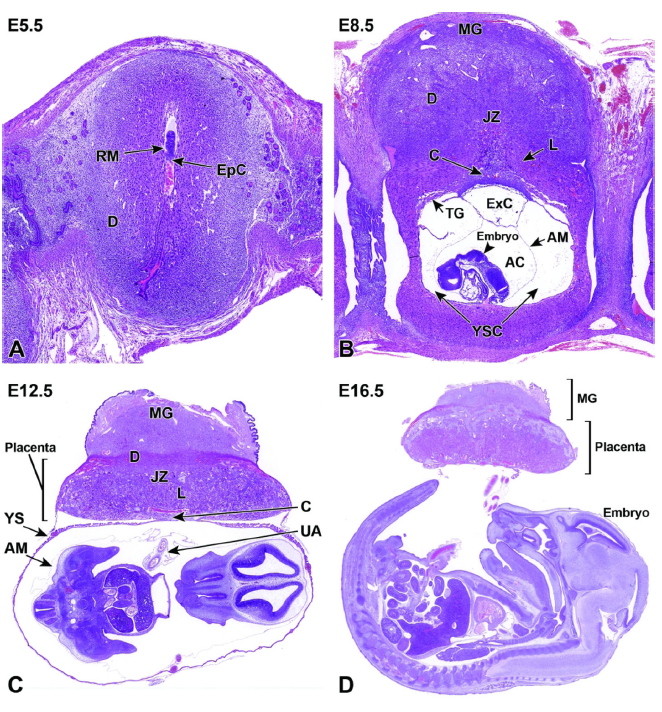
图2:子宫角单个植入位点在E5.5、E8.5、E12.5和E16.5处小鼠胎盘发育的代表性图像。
图A:E5.5时,通过滋养层巨细胞的持续伸长,异位胎盘锥(EpC)开始在子宫中膜极形成。
图B:E8.5时,从早期组织营养向血行营养的过渡始于迷路(L)的诱导,迷路是一个由多个分支通道组成的血管组织场,这些通道缠绕在滋养层细胞中,延伸到连接区(JZ)。外体腔(ExC)、羊膜腔(AC)和卵黄囊腔(YSC)在围绕胚胎时变得不同。滋养层巨细胞(TG)存在于胎盘的周围,胎盘现在已经形成了不同的层。绒毛膜板(C)位于胎盘盘的基部,而子宫腺(MG)位于帽部。
图C:在E12.5,最终胎盘完全形成并功能正常,卵黄囊(YS)围绕胚胎。脐动脉(UA)从胚胎延伸到胎盘的绒毛膜(C)。母体来源的子宫腺位于母体蜕膜(D)的顶部,此时蜕膜已经变得薄得多。括号内的胎盘层位于子宫腺下方。
图D:到E16.5,确定性胎盘的大小相对于胚胎有所减小(与图C相比),并且在制备过程中,由于细胞退化,胎盘质量略有减少为了出生。请注意,与胎盘相比,胚胎的大小较大。为了准备分娩和与子宫壁分离,母体蜕膜的数量变小(与图C相比)。其他缩写:AM=羊膜,RM=Reichert膜
E5.0–E6.0:卵柱、外胚层锥体和子宫腺。到E5.0时,壁滋养层细胞继续分裂,导致囊胚伸长,单向膨胀远离植入部位的子宫内膜侧,导致形成细长的卵柱。外胎盘锥呈三角形细胞帽状,延伸至子宫中蜕膜。外胎盘锥附近的母体血液空间开始积聚母体无核红细胞(aRBCs)。在H&E染色切片中,蜕膜化早期,整个蜕膜中的子宫自然杀伤细胞uNK细胞数量增加,uNK细胞含有许多圆形、深粉色的细胞质颗粒。
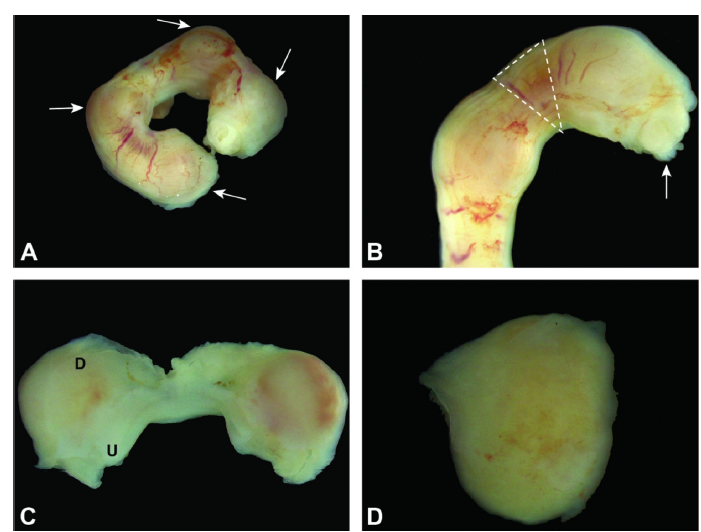
图3:子宫角和胚胎位于E5.5。图A:注意(箭头)识别为轻微肿胀。图B:切除子宫通常会导致胎儿通过切缘部分排出(箭头)。
虚线表示受孕之间的区域,在那里可以安全地抓住或切割子宫而不会破坏受孕。
图C:通过沿水平轴打开子宫(U),子宫缩回并露出整个母体蜕膜(D)。图D:然后可以很容易地分离概念(包含在母体蜕膜中)。

图4 E5.5处子宫角和三个植入部位的代表性图像。
图A:在妊娠早期,每个植入部位都应该单独取样,以找到理想的卵柱(EC)视图。注意(M)和(A)极点相对于发育中的卵柱的方向。在小鼠中,着床总是发生在子宫的反子宫内膜侧,而胎盘在子宫内膜侧发育。
图B:观察整个卵柱期胚胎和发育中的外胎盘锥(EpC)的理想纵向方向。Reichert膜(RM)是壁内胚层细胞和滋养层巨细胞(TG)之间的厚多层基底膜,有助于胚胎穿透子宫上皮并植入子宫内膜。注意周围的母体蜕膜(D)。
图C:卵柱的横截面,没有胚胎胎盘组织的发育视图。
E6.0–E7.5:卵黄囊腔、赖氏膜和羊膜腔。绒毛膜卵黄蛋白胎盘是通过滋养层细胞侵入母体蜕膜形成的,它通过产生第一层功能性胎盘膜——卵黄囊——以及一系列滋养层巨细胞、卵黄血管(将卵黄囊连接到胚胎心脏)和母体血管来支持这种胚胎转化。在卵黄囊和Reichert膜开始形成后不久(接近E6.0),促羊膜腔开始形成,作为羊膜腔的前体。
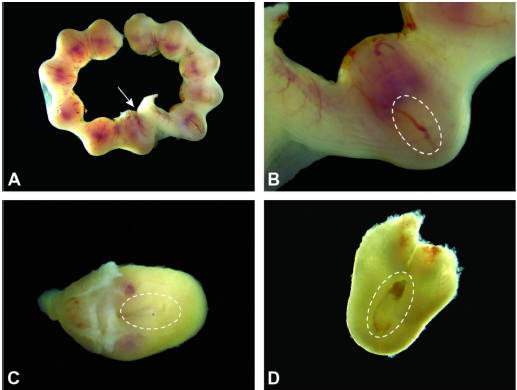
图5 子宫和妊娠期为E6.5。
图A:随着时间的推移,胎儿的生长使子宫肿胀更加明显。子宫颈的附件(箭头)位于两个子宫角的交界处。
图B:卵柱(位于虚线椭圆形内)由胚胎胚胎外部分形成内脏内胚层的细胞组成,位于远离母体蜕膜(最靠近子宫中极的淡红色区域)的位置。
图C:孤立的概念,卵柱(虚线椭圆形)的位置显示在母体蜕膜的外部。
图D:暴露在母体蜕膜中的卵圆柱体(虚线椭圆形)。盖在卵柱上的红色三角形是胚胎多层胎盘的原基。
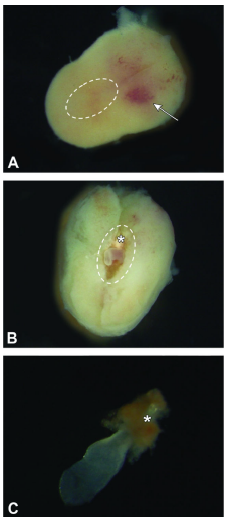
图 5 E7.5 图A:完整的胚胎具有一个稍宽的中胚层半部分,中心有淡红色区域(箭头),以及一个较窄的反中胚层半部,其中包含胚胎本身(即卵柱[虚线椭圆])。外壳完全由母体蜕膜组成。从箭头尖端的中纵轴平面开始,轻轻拨开母体蜕膜,使卵筒暴露在外,对胎盘的损伤最小。
图B:暴露的卵柱(虚线椭圆形)与中纵轴对齐,胚胎多层胎盘的初始部分(星号)位于最靠近子宫中极的位置。
图C:通过透明的胎盘膜(羊膜和卵黄囊)几乎看不到分离的胚胎本身。新生的胚胎多层胎盘(星号)位于一个红色锥体的极点。
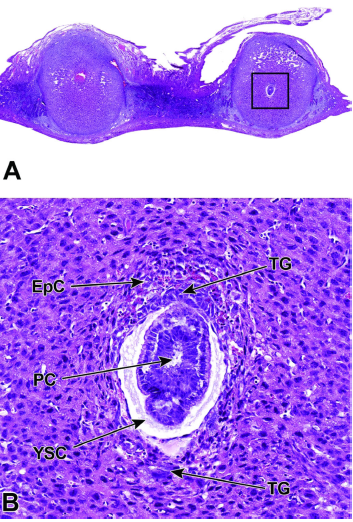
图6 E6.5处子宫角和两个植入部位的代表性图像。
图A:母体蜕膜和胚胎滋养层之间的相互作用是胚胎营养的主要来源。
图B:该植入部位(图A中的方框区域)的高倍放大显示,外胎盘锥(EpC)已经形成并含有母体血液,而滋养层巨细胞(TG)细胞包围着胚胎。
随着外胎盘锥的发育,原肠胚形成(形成三个主要的胚胎胚层——内胚层、中胚层和外胚层)开始同时形成促排卵腔(PC)。
在这个发育阶段,卵黄囊腔(YSC)清晰可见。卵黄囊腔是由内脏卵黄囊和壁卵黄囊分别沿着胚胎和囊胚壁内层形成的。
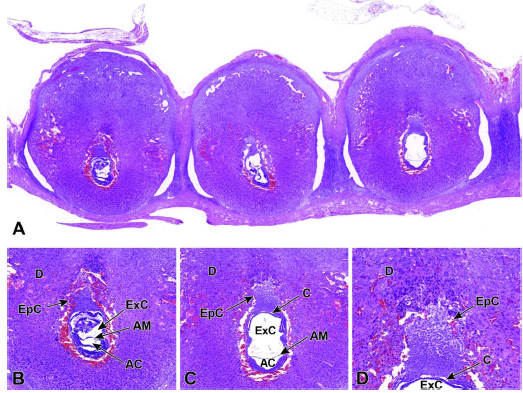
图7 子宫角的代表性图像显示E7.5处的三个植入部位。
图A:多个植入部位可以帮助正确老化和识别形成的胎盘(和胚胎)结构,因为当根据结构特征判断发育阶段时,相同实际年龄的胚胎可能相差24小时。
相邻植入部位的胎盘和胚胎的方向不同,只有一些显示出理想的视图。
图B和C:尿囊已经形成,并开始穿过外体腔(ExC)朝向绒毛膜板(C)。在尿囊跨越过程中,前羊膜腔和外体腔彼此不同,形成羊膜腔(AC)和羊膜(AM)。
图D:体外胎盘锥(EpC)侵入母体蜕膜(D)